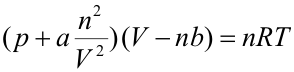Gases realesLa ecuación de estado de un gas ideal está basada en la hipótesis de que las interacciones entre las moléculas de un gas a densidad muy baja son despreciables. Además, en estas condiciones, las moléculas que constituyen el gas se consideran partículas puntuales. En el modelo de gas ideal, las sustancias siempre se encuentran en estado gaseoso. Sin embargo, el comportamiento de una sustancia real es mucho más complejo. Ésta puede experimentar lo que se denomina un cambio de fase o cambio de estado. Cuando a una sustancia se le suministra o extrae una cierta cantidad de calor, a nivel microscópico las interacciones entre sus moléculas cambian y, dependiendo de su estado termodinámico, puede encontrarse en estado sólido, líquido o vapor, o en una combinación de estos estados. Las isotermas de un gas real tienen una forma más compleja que las isotermas de un gas ideal (hipérbolas), ya que deben dar cuenta de los cambios de fase que puede experimentar. En la figura inferior se han representado las denominadas isotermas de Andrews. Dichas isotermas fueron medidas experimentalmente, y representan la presión en función del volumen a distintas temperaturas.
La isoterma representada en rojo se denomina isoterma crítica (y su temperatura, la temperatura crítica). Esta isoterma separa dos comportamientos: cuando una sustancia se encuentra a una temperatura superior a su temperatura crítica, siempre está en estado gaseoso, por muy alta que sea la presión. Por el contrario, cuando está a una temperatura inferior a la crítica, puede estar en estado sólido, líquido o vapor (en la gráfica se han representado solamente las zonas de líquido y vapor). Los puntos representados con las letras A y B corresponden respectivamente a los estados denominados vapor saturado y líquido saturado. Ambos están sobre una curva (representada en línea punteada) denominada curva de saturación. Por debajo de ella, todos los estados son una mezcla de líquido y vapor. En la figura también se observa que la zona de las isotermas que se encuentra por debajo de la curva de saturación es una recta horizontal. Por tanto, cuando el cambio de fase líquido - vapor se produce a presión constante, se produce también a temperatura constante. Para que una sustancia cambie de fase, es necesario suministrale o extraerle una cierta cantidad de calor. Si el cambio de fase se produce a presión constante, este calor no se traduce en un incremento de temperatura, y se denomina calor latente. Ecuación de estado de van der WaalsNo existe una única ecuación de estado que describa el comportamiento de todas las sustancias reales para todas las condiciones de presión y temperatura. A lo largo del tiempo se han propuesto distintas ecuaciones de estado, siendo la más sencilla la de van der Waals, por la que recibió el premio Nobel de Física en 1910. La ecuación de van der Waals es una modificación de la ecuación de estado de un gas ideal en la que se tiene en cuenta tanto el volumen de las moléculas como las interacciones entre ellas. Tiene la forma:
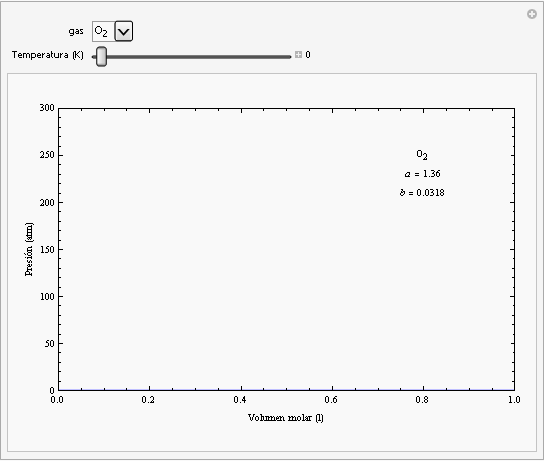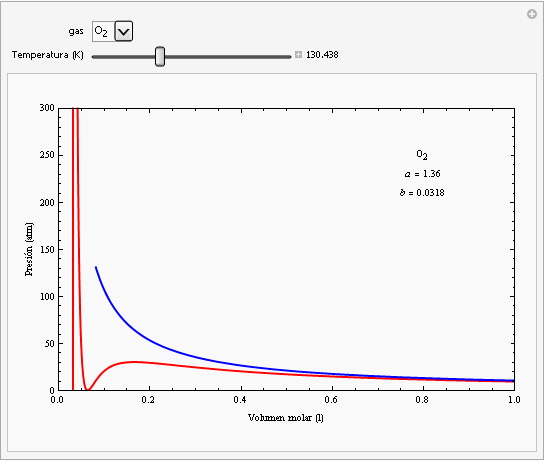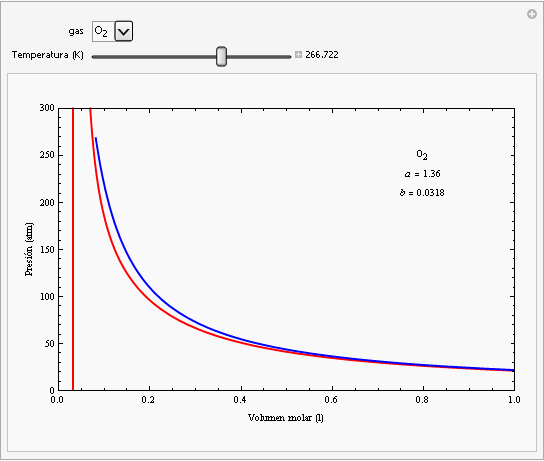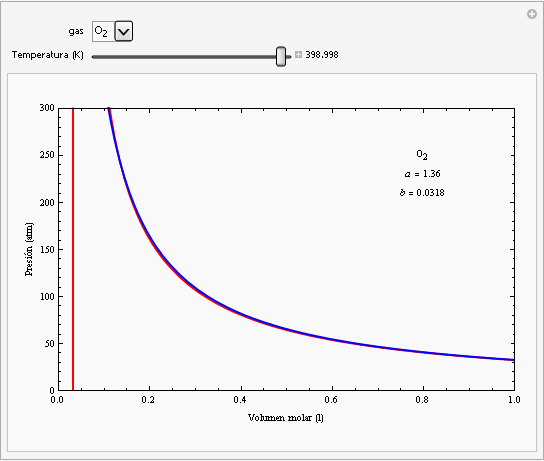
Las constantes a y b dependen del gas cuyo comportamiento se esté describiendo. En la siguiente animación se han representado las isotermas de la ecuación de van der Waals para el oxígeno (en rojo) junto con las isotermas de un gas ideal (en azul).
Como puede observarse, para valores altos de la temperatura y para valores bajos de la presión ambas ecuaciones dan el mismo comportamiento. Por otra parte, la ecuación de van der Waals describe la zona de las isotermas que corresponden al estado líquido (zona de la izquierda de pendiente elevada), mientras que no funcionan para la zona de las isotermas (recta horizontal de las isotermas de Andrews) que se encuentra por debajo de la curva de saturación. La isoterma crítica del oxígeno corresponde a una temperatura de aproximadamente -118ºC. |