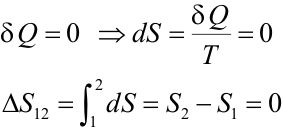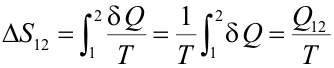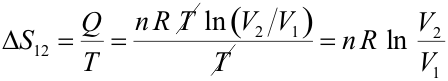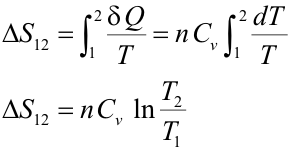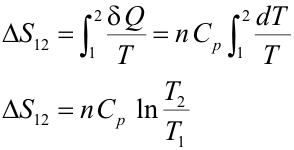Entropía (2/3)Aplicación a procesos reversibles de un gas idealA continuación se calcula la variación de entropía para las cuatro transformaciones reversibles más habituales que puede experimentar un gas ideal. Transformación adiabáticaUna transformación adiabática se caracteriza porque la sustancia de trabajo no intercambia calor, es decir:
Se cumple entonces que entre dos estados 1 y 2 unidos por una transformación adiabática reversible la entropía no varía; por ello estas transformaciones se denominan también isentrópicas. Transformación isotermaTeniendo en cuenta que la temperatura es constante podemos sacarla fuera de la integral en el cálculo de la variación de entropía:
Esta expresión se utiliza para calcular la variación de entropía de un foco térmico (dispositivo capaz de absorber o ceder calor sin modificar su temperatura). Haciendo uso de la expresión que da el calor intercambiado en una trasformación isoterma experimentada por un gas ideal:
Transformación isócoraUna transformación isócora es aquella en que el volumen permanece constante. Utilizando la expresión que da el calor intercambiado en una trasformación isócora se obtiene:
Transformación isóbaraPara calcular la variación de entropía en una transformación isóbara se sigue un procedimiento análogo al anterior; la única diferencia es que la capacidad calorífica para esta transformación es la capacidad calorífica a presión constante de un gas ideal:
Como puede observarse, en las dos últimas transformaciones un aumento de temperatura conlleva un aumento de entropía. |