IntroducciónEl Primer Principio de la Termodinámica implica que en todo proceso termodinámico la energía se conserva. Sin embargo, este principio no es suficiente para determinar si un proceso concreto puede ocurrir o no. Por ejemplo, en un proceso cíclico, se puede convertir todo el trabajo en calor pero no se puede producir el proceso inverso, es decir, transformar todo el calor absorbido en trabajo aunque en este caso tampoco se viole el Primer Principio. Mediante ese ejemplo se deduce también que no todas las formas de energía son igualmente aprovechables. Necesidad del Segundo PrincipioPor ello, es necesario establecer otro principio (Segundo Principio de la Termodinámica) que indique cuándo un proceso puede ocurrir y cuándo no, aunque se siga cumpliendo el Primer Principio. En este tema se darán varios enunciados del Segundo Principio, siendo todos ellos equivalentes. Se definirá también una nueva función de estado, llamada entropía (S), que permitirá caracterizar en qué sentido tienen lugar los procesos termodinámicos. EjemplosSe presentan algunos casos en los que el proceso siempre tiene lugar en el mismo sentido, aunque si ocurriera en el sentido inverso no se violaría el Primer Principio.
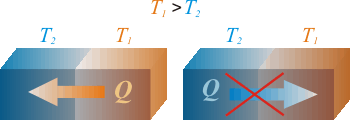 |

