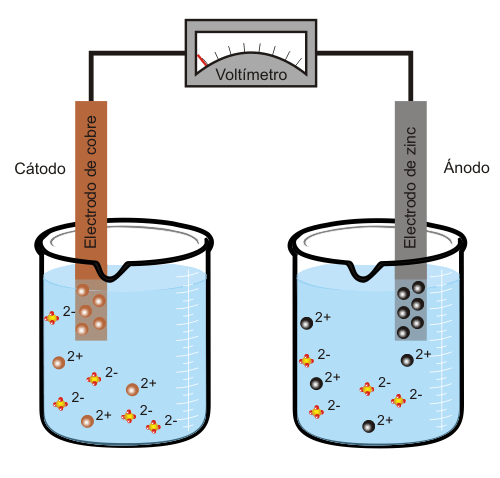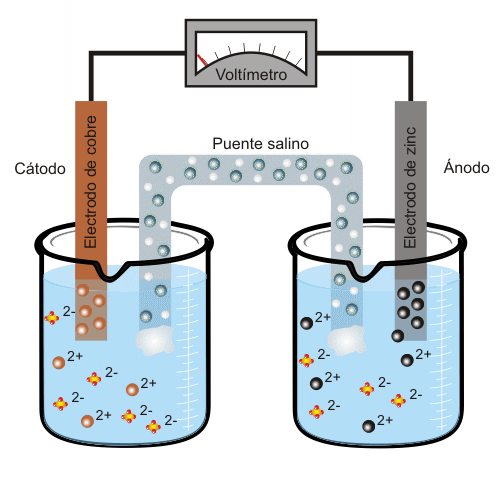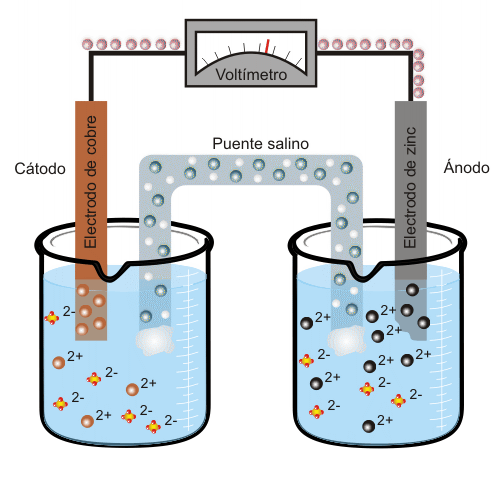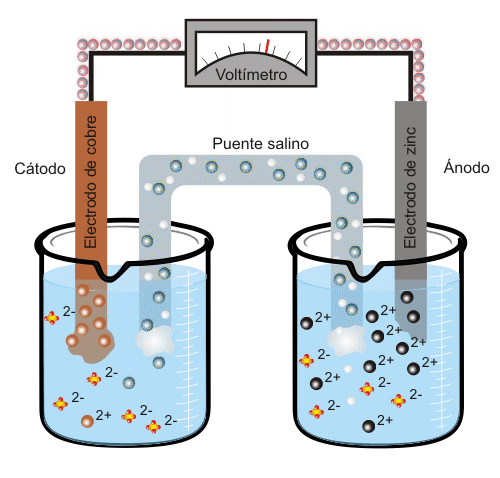
Pila eléctricaUna pila eléctrica es un dispositivo que transforma energía química en energía eléctrica. Está constituida por una o más células galvánicas como la que se muestra en la animación inferior. La célula de la figura consta de los siguientes elementos:
El zinc tiene mayor tendencia que el cobre a estar en disolución, por lo que liberará simultáneamente iones Zn2+ y electrones (dos por cada átomo de zinc). Se denomina ánodo al electrodo que libera electrones, en este caso, el electrodo de zinc. Cuando el ánodo se conecta mediante un hilo conductor con el electrodo de cobre (es el cátodo, ya que capta los electrones liberados por el ánodo) los iones de cobre que se encuentran en la disolución se incorporarán al electrodo en forma átomos de cobre Cu, por lo que se creará una corriente eléctrica. En el ejemplo de la figura la diferencia de potencial entre el ánodo y el cátodo es de aproximadamente 1.1 V.
Conforme aumenta el exceso de carga positiva en el recipiente que contiene los iones de zinc, el puente salino liberará inones Cl- para neutralizar dicha carga positiva. En el recipiente que contiene sulfato de cobre se producirá un exceso de carga negativa (ya que la cantidad de iones sulfato (SO2-) será mayor que la de iones cobre). Por tanto, para compensar este exceso de carga negativa, el puente salino liberará a su vez iones sodio (Na+) a dicho recipiente. Cuba electrolíticaEn una cuba electrolítica se da el proceso inverso al que tiene lugar en la pila eléctrica: se transforma energía eléctrica en energía química. Cuando por el dispositivo representado en la animación anterior se hace pasar una corriente eléctrica, los electrones van en sentido contrario al que se daría espontáneamente en la reacción química y serán los iones zinc quienes capten los electrones formándose átomos de zinc. En este caso el electrodo de zinc actuará como cátodo, ya que es el que capta dichos electrones, y el electrodo de cobre será el ánodo, al contrario que en la pila descrita más arriba. El proceso que tiene lugar en este caso se denomina electrolisis, y se emplea para separar un compuesto en los elementos que lo conforman así como para producir hidrógeno a partir de agua. |