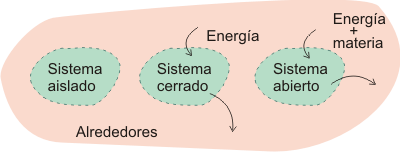
Sistema termodinámicoUn sistema termodinámico (también denominado sustancia de trabajo) se define como la parte del universo objeto de estudio. Un sistema termodinámico puede ser una célula, una persona, el vapor de una máquina de vapor, la mezcla de gasolina y aire en un motor térmico, la atmósfera terrestre, etc. El sistema termodinámico puede estar separado del resto del universo (denominado alrededores del sistema) por paredes reales o imaginarias. En este último caso, el sistema objeto de estudio sería, por ejemplo, una parte de un sistema más grande. Las paredes que separan un sistema de sus alrededores pueden ser aislantes (llamadas paredes adiabáticas) o permitir el flujo de calor (diatérmicas). Los sistemas termodinámicos pueden ser aislados, cerrados o abiertos.
En la siguiente figura se han representado los distintos tipos de sistemas termodinámicos.
A lo largo de estas páginas trataremos los sistemas cerrados. Cuando un sistema está aislado y se le deja evolucionar un tiempo suficiente, se observa que las variables termodinámicas que describen su estado no varían. La temperatura en todos los puntos del sistema es la misma, así como la presión. En esta situación se dice que el sistema está en equilibrio termodinámico. Equilibrio termodinámicoEn Termodinámica se dice que un sistema se encuentra en equilibrio termodinámico cuando las variables intensivas que describen su estado no varían a lo largo del tiempo. Cuando un sistema no está aislado, el equilibrio termodinámico se define en relación con los alrededores del sistema. Para que un sistema esté en equilibrio, los valores de las variables que describen su estado deben tomar el mismo valor para el sistema y para sus alrededores. Cuando un sistema cerrado está en equilibrio, debe estar simultáneamente en equilibrio térmico y mecánico.
|