Primer Principio. Aplicación a procesos reversibles (3/3)Transformación adiabáticaEn una transformación adiabática no se produce intercambio de calor del gas con el exterior (Q = 0). Se define el coeficiente adiabático de un gas (γ) a partir de las capacidades caloríficas molares tomando distintos valores según el gas sea monoatómico o diatómico: 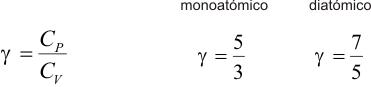 El gas se encuentra encerrado mediante un pistón en un recipiente de paredes aislantes y se deja expansionar. En este caso varían simultáneamente la presión, el volumen y la temperatura, pero no son independientes entre sí. Se puede demostrar usando el Primer Principio que se cumple: 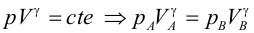 Haciendo cambios de variable mediante de la ecuación de estado del gas ideal, obtenemos las relaciones entre las otras variables de estado: 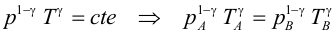 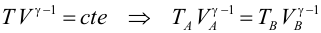 El trabajo realizado por el gas lo calculamos a partir de la definición, expresando la presión en función del volumen: 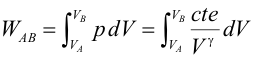 Integrando se llega a: 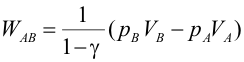 La variación de energía interna se calcula usando la expresión general para un gas ideal: 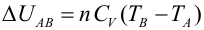 Aplicando el Primer Principio: 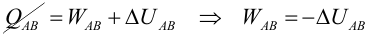 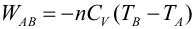 Es decir, en una expansión adiabática, el gas realiza un trabajo a costa de disminuir su energía interna, por lo que se enfría. En el proceso inverso, el gas se comprime (W<0) y aumenta la energía interna. En esta tabla encontrarás un resumen de cómo calcular las magnitudes trabajo, calor y variación de energía interna para cada transformación. |


