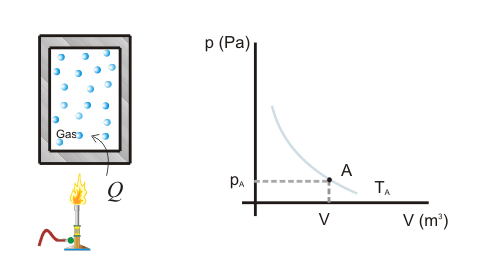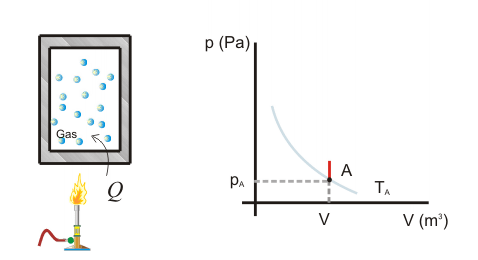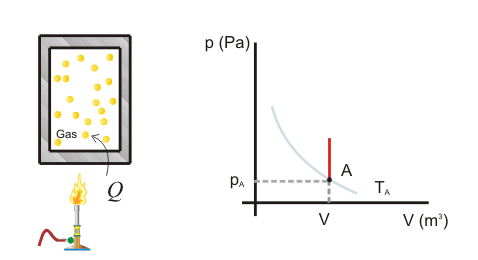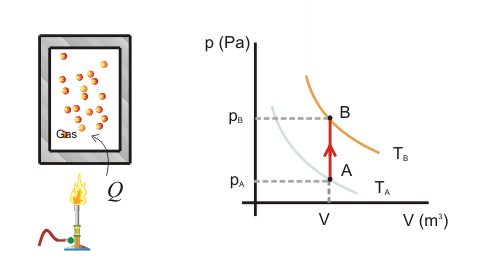
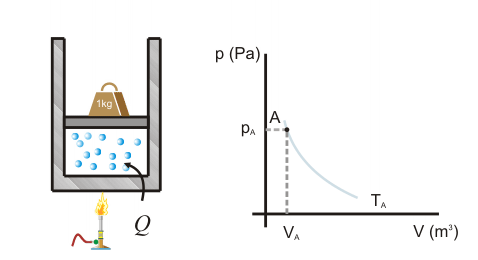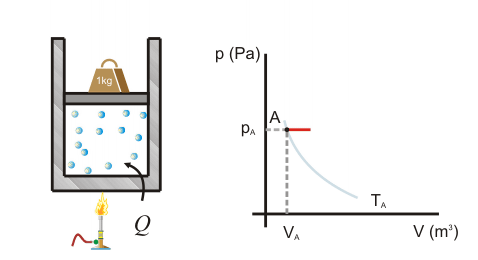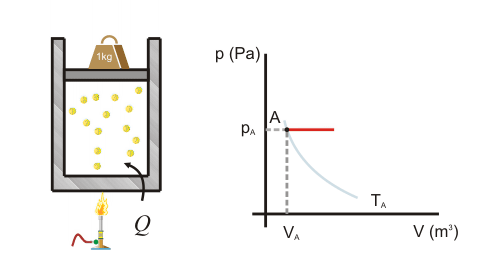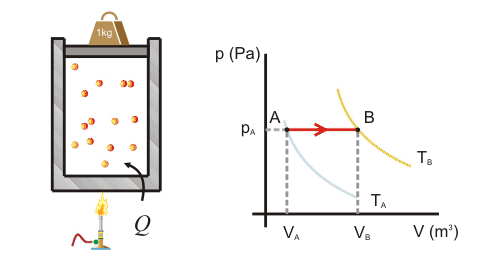
Primer Principio. Aplicación a procesos reversibles (2/3)Transformación isócoraEn una transformación isócora el volumen permanece constante. Imaginemos una cierta cantidad de gas ideal encerrado en un recipiente de paredes fijas, al que se le suministra calor por lo que el gas aumenta de temperatura y de presión. El trabajo realizado por el gas es nulo, ya que no hay variación de volumen. 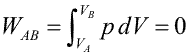 Aplicando el Primer Principio, se deduce que todo el calor intercambiado se invierte en variar la energía interna: 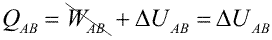 Recordando la expresión para la variación de energía interna de un gas ideal: 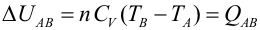 Es decir, por tratarse de calor absorbido (Q>0) el gas aumenta de temperatura. En la transformación inversa el gas se enfría cediendo calor al exterior y diminuyendo su presión. Transformación isobaraEn una transformación isobara la presión del sistema no varía. Supongamos que un gas ideal absorbe calor y, como consecuencia, se expande desde un estado inicial A a uno final B, controlando la presión para que esté en equilibrio con el exterior y permanezca constante. En este caso parte del calor absorbido se transforma en trabajo realizado por el gas y el resto se invierte en aumentar la energía interna. Calculamos el trabajo a partir de la definición integrando a lo largo de la transformación, teniendo en cuenta que la presión no varía: 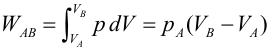 La variación de energía interna se calcula usando la expresión general para un gas ideal: 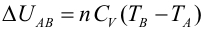 Para expresar la relación entre el calor y la variación de temperatura usaremos ahora la capacidad calorífica a presión constante Cp: 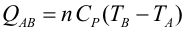 Además, se debe cumplir el Primer Principio, es decir: 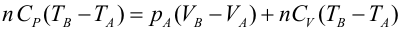 Recordando que por ser un gas ideal pV=nRT, el segundo miembro de la ecuación se puede escribir: 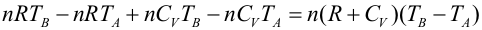 Esta ecuación nos permite obtener una relación entre las capacidades caloríficas de un gas a volumen y a presión constante, conocida como Ley de Mayer: 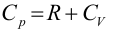
|