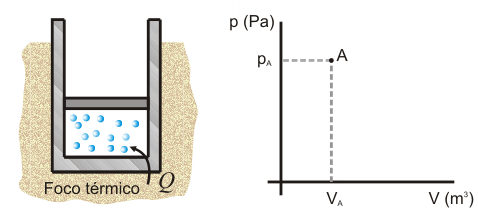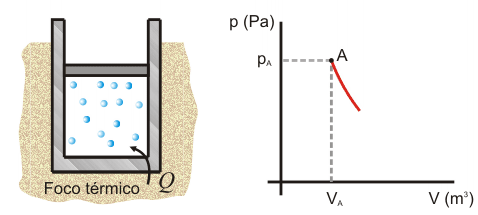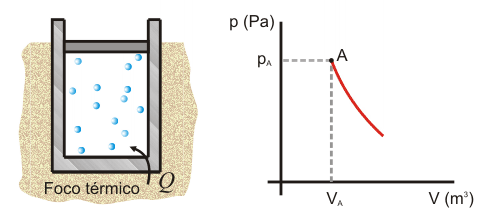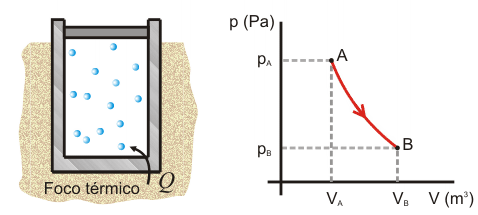
Primer Principio. Aplicación a procesos reversibles (1/3)Aplicamos el Primer Principio a los procesos reversibles más importantes, suponiendo siempre como sustancia de trabajo un gas ideal. Calcularemos en cada caso el calor, el trabajo y la variación de energía interna. Recordemos que la temperatura se expresa en Kelvin, la presión en Pascales y el volumen en metros cúbicos. Con estas unidades, la constante de los gases ideales es R = 8.31 J/Kmol. Las ecuaciones que vamos a aplicar en cada transformación son entonces:  Transformación isotermaEn una transformación isoterma la temperatura del sistema permanece constante; para ello es necesario que el sistema se encuentre en contacto con un foco térmico que se define como una sustancia capaz de absorber o ceder calor sin modificar su temperatura. Supongamos que un gas ideal absorbe calor de un foco térmico que se encuentra a una temperatura To y como consecuencia, se expande desde un estado inicial A a uno final B. El proceso es isotermo por mantenerse el gas en contacto con el foco (TA=TB=T0), por lo que, la variación de energía interna será nula:  Calculamos el trabajo, sustituyendo el valor de la presión en función del volumen y de la temperatura, según la ecuación de estado del gas ideal:  Integrando, obtenemos la expresión para el trabajo realizado por el gas en una transformación isoterma a T0:  Este trabajo es positivo cuando el gas se expande (VB>VA) y negativo cuando el gas se comprime (VA>VB). Aplicamos el Primer Principio para calcular el calor intercambiado:  Es decir, todo el calor absorbido se transforma en trabajo, ya que la variación de energía interna es nula. En el proceso inverso tanto el calor como el trabajo son negativos: el gas sufre una compresión y cede calor al foco. |